|
Результаты большого числа проведенных
клинических исследований, а также данные, полученные в ходе
5-летней постмаркетинговой программы, свидетельствуют о
высокой эффективности и безопасности валацикловира в лечении
заболеваний, вызванных вирусом простого герпеса (ВПГ).
Биодоступность валацикловира при приеме внутрь превышает
биодоступность ацикловира. Показана высокая эффективность и
переносимость супрессивной терапии ацикловиром при
назначении на длительный (до 10 лет) срок. Ацикловир одобрен
для использования в педиатрической практике. В некоторых
странах ацикловир доступен в виде мази для лечения
герпетического поражения губ (herpes
labialis). Нами проанализированы данные по
безопасности длительного применения валацикловира,
полученные в ходе клинических исследований. В общей
сложности в них было включено более 3000 пациентов с
заболеваниями, вызванными ВПГ, с нормальной иммунной
функцией и с иммунодефицитом. Кроме того, прослежено течение
беременности у более чем 1000 женщин, принимавших
валацикловир. Профили безопасности валацикловира (£1000
мг/день), ацикловира (800 мг/день) и плацебо оказались
одинаковыми. Анализ чувствительности изолятов ВПГ к
противовирусным препаратам показал, что резистентность к
ацикловиру возникает крайне редко: менее чем у 0,5% у
пациентов с нормальным иммунитетом и у 5% больных с
иммунодефицитом.
Ацикловир был создан около двадцати лет назад; пять лет
назад был лицензирован валацикловир, представляющий собой
пролекарство ацикловира. За это время накоплено большое
количество данных по клиническому применению этих
селективных противогерпетических препаратов. Подсчитано, что
в общей сложности ацикловир и валацикловир принимали более
80 миллионов пациентов с различными заболеваниями
(собственные результаты
GlaxoSmithKline).
Валацикловир назначают для длительной (от нескольких месяцев
до нескольких лет) профилактики (подавления) рецидивов
кожно-слизистого герпеса, не представляющего угрозы жизни.
Препарат показал высокий терапевтический индекс, отличную
эффективность и переносимость. Еще одной важной особенностью
валацикловира при лечении заболеваний, вызванных ВПГ,
является крайне низкая вероятность развития резистентности.
В клинических исследованиях, посвященных
изучению эффективности терапии валацикловиром длительностью
до 1 года, приняли участие более 10000 пациентов. Первыми
предпосылками к разработке валацикловира послужили
исследования, изучавшие эффекты ацикловира при пероральном и
внутривенном назначении. В последующем эффективность
ацикловира в лечении рецидивирующего генитального герпеса
была оценена в долгосрочных клинических исследованиях,
длительность наблюдения в которых достигала 10 лет. Кроме
того, эффективность ацикловира оценивали в педиатрической
практике, а также в группе больных с различными формами
иммунодефицита. Имеются многочисленные наблюдения за
влиянием ацикловира на течение и исход беременности. Анализ
чувствительности ВПГ к ацикловиру позволил расширить
возможности кратко- и долгосрочного применения
валацикловира.
Ацикловир обладает высокой специфичностью к клеткам,
инфицированным герпесвирусами. Проникнув в клетку,
инфицированную ВПГ и varicella zoster, ацикловир селективно
активируется вирусной тимидинкиназой. В активной форме
ацикловир специфично подавляет репликацию вируса, выступая в
роли конкурентного субстрата ДНК-полимеразы вируса,
предотвращая дальнейшее удлинение цепи вирусной ДНК.
Противовирусная активность и селективность ацикловира
обусловлены именно этим уникальным механизмом действия. Во
многом это находит отражение и в профиле клинической
безопасности ацикловира и валацикловира.
В
настоящей статье представлены основные результаты
длительного применения валацикловира при заболеваниях,
вызванных ВПГ. Рассмотрены вопросы безопасности применения
валацикловира и ацикловира в различных группах пациентов.
Кроме того, представлены результаты недавно завершившихся
исследований, показавших, что, несмотря на длительный прием
ацикловира в анамнезе, резистентность ВПГ к валацикловиру
развивается исключительно редко.
Опыт применения ацикловира
Опыт применения при генитальном
герпесе. В 1984 году
было начато исследование, целью которого явилась оценка
эффективности перорального ацикловира в профилактике
рецидивов генитального герпеса. В исследование было включено
1175 пациентов с часто рецидивирующим генитальным герпесом
без сопутствующих заболеваний [1,2]. В течение первого года
исследование было двойным слепым. Пациентов рандомизировали
в две группы и назначали ацикловир (400 мг 2 раза в день)
или плацебо. В случае возникновения рецидива в обеих группах
назначали ацикловир (200 мг 5 раз в день в течение 5 дней).
На втором году исследование переходило в открытую фазу, и
пациенты получали супрессивную (профилактическую) терапию
либо эпизодическое лечение (лечение рецидивов) либо
прекращали участие в исследовании. С 3 по 6 годы пациенты
получали супрессивную терапию ацикловиром, а в течение 7
года – только эпизодическую терапию (лечение рецидивов)
ацикловиром (200 мг 5 раз в день в течение 5 дней).
Пациентам, у которых за 7 лет происходило 2 или более
рецидивов генитального герпеса, предлагали длительную
супрессивную терапию ацикловиром (400 мг 2 раза в день) в
течение последующих 3 лет.
В
течение двойной слепой фазы лечения частота нежелательных
явлений в группах лечения ацикловиром и плацебо оказалась
сопоставимой. Наиболее часто встречались тошнота, диарея и
головная боль. В течение 1 года появление тошноты отметили
4,8% пациентов, получавших супрессивную терапию, и 2,4%
больных, принимавших плацебо. Однако в последующие годы
исследования частота этого явления уменьшилась до <1%. В
течение последующих лет исследования ацикловир также показал
хорошую переносимость. Нежелательные побочные явления
встречались редко, были слабо выраженными и редко связанными
с приемом исследуемого препарата. Серьезные нежелательные
явления отмечены не были. Не было получено и свидетельства
кумуляции токсических эффектов препарата (таблица 1).
Опыт применения в педиатрической
практике. В
большинстве стран, в т.ч. в Соединенных Штатах, ацикловир
для приема внутрь в виде суспензии одобрен для назначения
детям, страдающим ветряной оспой, без сопутствующих
заболеваний. Ацикловир также одобрен для назначения детям,
страдающим кожно-слизистым герпесом, с нормальной иммунной
функцией и иммунодефицитом (в большинстве стран, за
исключением США). В клинических исследованиях, изучавших
эффективность ацикловира в этих группах больных, препарат
показал хорошую переносимость [3-5]. В группе 815 детей
(возраст 2-12 лет), принимавших ацикловир по поводу ветряной
оспы (20 мг/кг 4 раза в день в течение 5 дней), характер и
частота нежелательных явлений оказались сходными с
пациентами, получавшими плацебо. Наиболее часто встречались
нежелательные явления со стороны желудочно-кишечного тракта.
Единственным отмеченным серьезным нежелательным явлением
оказалось развитие мозжечковой атаксии и дезориентации в
группе детей, получавших плацебо, что было связано с
основным заболеванием. У нескольких детей были отмечены
незначительное увеличение активности аспартаттрансаминазы,
лейкопения и тромбоцитопения. Между тем, различий между
группами лечения отмечено не было, поэтому выявленные
изменения не были связаны с приемом ацикловира [5]. В
плацебо-контролируемом исследовании, включившем 133 ребенка
в возрасте 1-6 лет с гингивостоматитом, половина получала
суспензию ацикловира (15 мг/кг 5 раз в день в течение 7
дней). У двоих детей в каждой группе возникли слабо
выраженные желудочно-кишечные симптомы, однако существенных
нежелательных явлений ни в одной группе отмечено не было
[3]. В другом открытом исследовании изучали эффективность
терапии пероральным ацикловиром (300 мг/м2/кг 2-3
раза в день) с целью профилактики рецидивов герпеса у 26
детей, перенесших неонатальное герпетическое поражение кожи,
глаз и слизистой оболочки рта. У 12 детей отмечено появление
нейтропении. Несмотря на продолженное лечение ацикловиром,
число лейкоцитов крови вернулось к норме у 10 из них. В 2
случаях нормализация числа лейкоцитов произошла после
уменьшения дозы ацикловира или его отмены [6].
Ацикловир и беременность.
С целью учета случаев
применения ацикловира во время беременности и его влияния на
плод в 1984 году был создан Регистр «Ацикловир и
Беременность». В регистр вносили все сведения, полученные в
результате проспективного наблюдения за течением
беременности на фоне приема ацикловира. К 31 июля 1998 года
в Регистр были включены 1207 случаев беременности [7]. В 581
случае беременности ацикловир использовался в первом
триместре; врожденные дефекты выявлены у 19 новорожденных.
Риск развития врожденных дефектов составил 3,3% (95%
доверительный интервал 2,0-5,2%). Эти результаты сопоставимы
с опубликованными данными по риску возникновения врожденных
дефектов в общей популяции (3-5%). При анализе всех случаев
беременности, без учета триместра, в котором использовался
ацикловир, врожденные дефекты выявлены у 27 детей (2,2%).
Таким образом, частота встречаемости врожденных дефектов на
фоне приема ацикловира не превысила ожидаемую частоту для
общей популяции. Характер врожденных дефектов также не
отличался от общей популяции. Между тем, размер Регистра
недостаточен для того, чтобы сделать однозначный вывод о
безопасности применения ацикловира при беременности и о его
влиянии на развивающийся плод. По всей видимости, принимая
решение о назначении любого препарата во время беременности
(включая ацикловир), врач должен взвешивать возможный риск и
возможную пользу как для матери, так и для плода.
Использование ацикловира при беременности в различных
клинических ситуациях изучали и в слепых исследованиях.
Препарат назначали на поздних сроках беременности в качестве
супрессивной терапии заболеваний, вызванных ВПГ, с целью
профилактики передачи вируса новорожденному во время родов.
Кроме того, изучали возможность назначения ацикловира
женщинам, носителям
varicella,
с повышенным риском развития пневмонии, вызываемой этим
микроорганизмом [8-12]. По данным нескольких небольших
исследований назначение ацикловира (800-1200 мг в день в 3
или 4 приема) за несколько недель до предполагаемых родов
снижает частоту клинически выраженных рецидивов ВПГ, а также
уменьшает потребность в выполнении Кесарева сечения в связи
с генитальным герпесом [8-10]. Переносимость лечения была
высокой, характер и частота возникновения нежелательных
явлений в группе активного лечения и в группе плацебо
оказались практически одинаковыми. Более того, наблюдение за
состоянием 19 рожденных детей продолжали до достижения срока
1 год с момента назначения ацикловира матери. За этот период
краткосрочных нежелательных явлений отмечено не было. В
настоящее время не установлено, может ли ацикловир оказывать
нефротоксическое действие и вызывать нейтропению у
развивающегося плода. Для оценки долгосрочной безопасности
применения ацикловира во время беременности, его влияния на
плод, организм новорожденного и развивающегося ребенка
необходимы дальнейшие исследования.
В 1995
году в Регистр «Ацикловир и Беременность» были добавлены
случаи применения во время беременности валацикловира; они
представлены в настоящей статье. В 1999 году Регистр был
закрыт для дальнейших записей. Поводом послужило то, что
число новых сообщаемых случаев использования препарата при
беременности в последние 3-4 года было существенно ниже
того, что, по всей видимости происходило в реальной
клинической практике. Кроме того, накопленные новые данные
были сочтены недостаточными для того, чтобы внести
какие-либо изменения в существующую базу данных.
Опыт применения валацикловира
Предпосылки к созданию.
Ацикловир стал первым
пероральным препаратом, специфично и эффективно
воздействующим на герпесвирусы. Однако, ацикловир обладает
низкой биодоступностью при приеме внутрь (10-20%) [13], что
требует назначения препарата до 5 раз в день для достижения
терапевтической эффективности. Валацикловир был создан для
перорального применения при заболеваниях, вызванных
герпесвирусами, в том числе, менее чувствительными к
ацикловиру, чем ВПГ, и требующими более высокой концентрации
препарата для подавления вируса, а также уменьшения
кратности приема препарата.
Валацикловир является
L-валиновым
эфиром ацикловира. В организме он быстро и практически
полностью превращается в ацикловир и
L-валин
[14]. Биодоступность ацикловира после приема валацикловира
внутрь в 3-5 раз превышает таковую после перорального приема
самого ацикловира [14]. Ацикловир плохо всасывается, и его
биодоступность составляет 10-20% в зависимости от принятой
дозы. Напротив, после приема валацикловира содержание
ацикловира в плазме крови увеличивается практически
пропорционально принятой дозе, и его биодоступность у
взрослых достигает 50% и более. В таблице 2 представлены
основные показатели, отражающие содержание ацикловира в
плазме крови, после приема внутрь ацикловира и валацикловира
у пациентов с заболеваниями, вызванными ВПГ. Фармакокинетика
ацикловира после приема валацикловира у лиц с нормальным
иммунитетом и больных ВИЧ-инфекцией не различается,
Cmax
и AUC
приближаются к расчетным показателям [15-18]. Результаты
доклинических токсикологических исследований свидетельствуют
о том, что профиль безопасности валацикловира существенно не
отличается от профиля безопасности ацикловира [19].
Долгосрочная безопасность при лечении
генитального герпеса.
Эффективность и долгосрочная безопасность перорального
валацикловира, используемого в качестве супрессивной терапии
пациентов с генитальной герпесвирусной инфекцией, были
изучены в трех рандомизированных контролируемых
исследованиях и одном открытом исследовании (таблица 3)
[16-18,20]. В общей сложности в эти исследования было
включено 3050 пациентов (1062 из них с иммунодефицитом).
2206 пациентов принимали валацикловир в дозе 250-1000 мг в
день в течение различного периода времени, до 1 года
(таблица 3). В группе пациентов с нормальным иммунитетом
прием валацикловира в дозе
³500
мг 1 или 2 раза в день достоверно предотвращал или
увеличивал время до появления рецидива в сравнении с
плацебо. Эффективность валацикловира была сопоставимой с
результатами лечения ацикловиром в дозе 400 мг 2 раза в день
[16,17]. У больных с ВИЧ-инфекцией (таблица 3, исследование
4) валацикловир в дозе 500 мг 2 раза в день более
эффективно, чем валацикловир в дозе 1000 мг 1 раз в день
предотвращал или увеличивал время до возникновения рецидива
герпеса. Отмечена тенденция к более высокой эффективности
валацикловира в сравнении с ацикловиром [18].
Нежелательные явления, отмеченные пациентами, получавшими
валацикловир, ацикловир и плацебо, оказались сопоставимыми
по характеру и частоте (таблица 4). При этом явной
взаимосвязи между характером наиболее частых нежелательных
явлений, их тяжестью и частотой возникновения с одной
стороны и дневной дозой валацикловира отмечено не было
(данные не представлены). Наиболее частым нежелательным
явлением у иммунокомпетентных пациентов, принимавших
валацикловир и ацикловир, являлась головная боль, развитие
инфекционных заболеваний (грипп, банальная простуда, ринит,
синусит) и тошнота. Среди больных ВИЧ-инфекцией чаще всего
отмечались диарея, тошнота и развитие инфекционных
заболеваний. Не было обнаружено взаимосвязи между длительным
приемом валацикловира и гематологическими сдвигами
(изменение уровня гемоглобина, числа тромбоцитов и
лейкоцитов), а также изменениями биохимических показателей
крови (содержание креатинина, аланинаминотрансферазы и
щелочной фосфатазы). Кроме того, не было отмечено различий
между группами приема валацикловира, ацикловира и плацебо.
Прием валацикловира прекратили 5 (0,3%) пациентов с
нормальным иммунитетом. Причинами послужили появление
нейтропении, лейкопении, тромбоцитопении, повышение уровня
АЛТ и изменение других «печеночных» показателей. В группе
ВИЧ-инфицированных пациентов прием валацикловира был
досрочно прекращен у 3 (0,4%) пациентов в связи с повышением
уровня креатинина, нарушений функции печени и увеличением
уровня АЛТ. Ацикловир досрочно прекратили принимать 4 (1,1%)
пациента в связи с повышением уровня креатинина, нарушением
функции печени, развитием гиперкалиемии и лейкопении.
Большинство нежелательных явлений исследователи не сочли
связанными с приемом препарата (таблица 4). Наиболее частыми
нежелательными явлениями, связанными с приемом исследуемых
препаратов, были головная боль, тошнота и диарея. Ринит,
фарингит и инфекционные заболевания достаточно часто
встречались среди нежелательных явлений, однако их появление
редко было связано с приемом исследуемого препарата. По всей
видимости, описанные явления являлись конкурирующими
заболеваниями. Похожая ситуация наблюдалась и среди
ВИЧ-инфицированных пациентов: появление сыпи, лихорадки,
диареи, депрессии, кашля, астении и рвоты могло быть
обусловлено как собственно ВИЧ-инфекцией, так и приемом
сопутствующей терапии. Причиной кожных изменений могла также
стать повышенная чувствительность ВИЧ-инфицированных
пациентов к появлению лекарственной сыпи.
Серьезные нежелательные явления отмечены у 2,4% пациентов с
нормальной функцией иммунитета. Между тем, лишь у 3 (0,2%)
больных их появление было охарактеризовано как «вероятно
связанное» с приемом валацикловира (лейкопения, гепатит и
головная боль), и у 2 (0,7%) – с приемом ацикловира
(миастения и суицидальные мысли). Один пациент умер от
бронхиальной астмы, что не было связано с приемом
валацикловира.
Серьезные нежелательные явления отмечены у 10,5%
ВИЧ-инфицированных пациентов. Вероятная связь с исследуемым
препаратом отмечена у 8 (1,1%) пациентов в группе лечения
валацикловиром и у 3 (0,9%) больных, принимавших ацикловир.
Наиболее частыми серьезными нежелательными явлениями были
желудочно-кишечные нарушения и головная боль. Восемь
пациентов, принимавших валацикловир, умерли. Причинами
смерти послужили прогрессирование ВИЧ-инфекции (n=2),
убийство (n=2),
сепсис / септический шок (n=2),
самоубийство (n=1)
и пневмония
(n=1).
Из пациентов, принимавших ацикловир, погибли двое (лактацидоз
и убийство). Только в одном случае была предположена связь
летального исхода с исследуемым препаратом (развитие
лактацидоза на фоне приема ацикловира).
В
исследованиях, изучавших эффективность длительного приема
валацикловира (от нескольких месяцев до нескольких лет) в
высоких дозах (8000 мг в день) с целью профилактики
цитомегаловирусной инфекции, было отмечено появление
симптомов, напоминавших тромботическую микроангиопатию.
Наиболее часто это наблюдалось у ВИЧ-инфицированных
пациентов [21-23]. У описанного явления может быть множество
причин: значительное подавление иммунитета, основное
заболевание (поздние стадии ВИЧ-инфекции, реакция
трансплантат против хозяина), а также прием препаратов
других классов, в первую очередь противогрибковых препаратов
[20, 22-24]. Ни у одного из 3050 пациентов, участвовавших в
4 исследованиях эффективности валацикловира в профилактике
рецидивов генитального герпеса, не было отмечено развития
тромботической микроангиопатии. Однако, только в одном из
них принимали участие ВИЧ-инфицированные больные, при этом
среди них не было пациентов с поздними стадиями
ВИЧ-инфекции. Таким образом, риск развития тромботической
микроангиопатиии присутствует лишь у пациентов с тяжелой
иммуносупрессией, получающих высокие дозы валацикловира,
превышающие необходимые для подавления герпетической
инфекции.
Возможность применения валацикловира
в педиатрической практике.
Эффективный, удобный для приема и приятный на вкус
антигерпесвирусный препарат крайне необходим детям всех
возрастов – от новорожденных до подростков. В первую очередь
он необходим для профилактики герпетической инфекции у детей
с иммунодефицитом. В некоторых странах ацикловир доступен в
виде суспензии. Суспензия имеет приятный вкус, ее легко
глотают даже маленькие дети. Однако низкая биодоступность
требует многократного приема в течение дня. Валацикловир мог
бы обеспечить гораздо более удобный режим дозирования,
однако физико-химические свойства молекулы до настоящего
времени не позволяли произвести жидкую форму препарата с
необходимыми свойствами [25]. Тем не менее, опыт
использования в педиатрической практике содержащего
валацикловир сиропа уже есть [25]. Необходимо отметить, что
этот сироп готовится только «для немедленного применения» и
сохраняет химическую и микробиологическую стабильность в
течение
³21
дней.
Результаты 3 предварительных исследований, включивших детей
с нормальным иммунитетом и иммунодефицитом в возрасте 1,4-18
лет, показали, что фармакокинетика ацикловира после приема
валацикловира у детей и взрослых существенно не различается
[26-28]. Биодоступность ацикловира после приема
валацикловира у детей составляет 45-48%; более того,
результаты исследования позволяют предположить, что
пероральный валацикловир может заменить ацикловир для
внутривенного введения [26,28]. В настоящее время данных о
безопасности применения валацикловира у детей младше 12 лет
не получено. В одном исследовании изучалась эффективность
валацикловира (8 г в день в течение 90 дней) с целью
профилактики цитомегаловирусной инфекции после пересадки
почки у детей
³13
лет. Препарат показал хорошую переносимость [29].
Применение валацикловира при
беременности. В
Регистр «Ацикловир и Беременность» внесены данные по 111
случаям беременности женщин, принимавших валацикловир.
Частота врожденных дефектов не превышала наблюдаемую в общей
популяции. Характер дефектов не был однотипным, что
позволяет исключить наличие у них единой причины.
Фармакокинетика валацикловира (500 мг 2 раза в день) и
ацикловира (400 мг 3 раза в день) изучена у 20 женщин,
получавшим антигепресвирусную терапию на поздних сроках
беременности [30]. Ацикловир накапливался в амниотической
жидкости, однако, данных в пользу преимущественного
накопления препарата в тканях плода получено не было.
Среднее соотношение концентрации в материнской / пуповинной
крови во время родов составило 1,7 для валацикловира и 1,3
для ацикловира. Валацикловир показал очень хорошую
переносимость. Клинических и лабораторных признаков
токсического эффекта препарата на мать и ребенка в течение
6-месячного периода наблюдения отмечено не было. В настоящее
время число случаев использования валацикловира во время
беременности невелико, поэтому для оценки безопасности и
клинической эффективности супрессивной терапии
валацикловиром на поздних сроках беременности необходимы
дальнейшие исследования.
Резистентность
(невосприимчивость)
ВПГ
Механизмы резистентности.
Мутации в геноме ВПГ могут
привести к дефициту или изменению активности фермента
тимидинкиназы вируса. В результате нарушается
фосфорилирование ацикловира, развивается резистентность к
терапии. [31]. Этот механизм резистентности к ацикловиру
встречается наиболее часто. Более того, это может привести к
перекрестной резистентности вируса к другим аналогам
нуклеозидов, активация которых происходит путем
фосфорилирования и зависит от тимидинкиназы (например,
пенцикловир, ганцикловир). Иногда в результате изменения
структуры тимидинкиназы сохраняется ее способность к
фосфорилированию исходного субстрата тимидина, однако,
избирательно теряется способность фосфорилировать ацикловир
[31]. В некоторых случаях нормальная активность
тимидинкиназы сохраняется лишь частично (1-15%), тем не
менее, это приводит к формированию резистентности к
ацикловиру [31]. Еще одним, достаточно редким механизмом
резистентности являются мутации в гене вирусной
ДНК-полимеразу, приводящие к тому, что ацикловиртрифосфат
перестает включаться в молекулу ДНК [32,33].
Методы определения чувствительности
изолятов ВПГ к ацикловиру.
Несмотря на то, что ацикловир широко применяется вот уже
более двух десятилетий, резистентность к ацикловиру у лиц с
нормальным иммунитетом встречается крайне редко. По
результатам недавно завершившихся в Великобритании и
Соединенных Штатах исследований
in vitro
частота резистентности ВПГ к ацикловиру составляет 0,1-0,4%
[34,35]. Чувствительность к препарату сохраняли даже изоляты
ВПГ, выделенные от пациентов, получавших супрессивную
терапию ацикловиром в течение 6 лет [36]. У больных с
иммунодефицитом резистентность также встречается нечасто
(5-6%) [34,35,37-39].
Широкое использование местных противовирусных мазей для
лечения герпеса на губах (herpes
labialis) вызвало
обеспокоенность по поводу развития резистентности ВПГ-1. В
недавно проведенном исследовании изучалась восприимчивость
924 изолятов ВПГ-1, выделенных из герпетических высыпаний на
губах, методом розеток [40]. Резистентность к ацикловиру
выявлена только у 1 (0,1%) изолята (ПК50³8,8
мкМ); он также оказался резистентным к пенцикловиру (ПК50³8,8
мкМ). Из обследованных пациентов 79% ранее использовали
местные противовирусные препараты для лечения «простуды»,
однако это не оказало влияния на восприимчисость к
ацикловиру (Р=0,160) или пенцикловиру (a).
Чувствительность ВПГ к ацикловиру и
валацикловиру. После
появления валацикловира как средства лечения генитального
герпеса было продолжено изучение резистентности изолятов ВПГ
к ацикловиру. В проведенных четырех исследованиях
эффективности супрессивной терапии валацикловиром данных за
наличие резистентности ВПГ получено не было (таблица 3,
рисунок 1) [16-18, 20, 41]. Двадцать два изолята ВПГ,
выделенных из высыпаний у 19 пациентов с рецидивирующим
генитальным герпесом и нормальным иммунитетом, получавших
валацикловир длительностью до 48 недель, были изучены
in
vitro
на чувствительность
к ацикловиру, пенцикловиру и фоскарнету. Все изоляты ВПГ-2
продемонстрировали «бурный» ответ на все 3 противовирусных
препарата: ПК50, определенная методом розеток,
составила <3,9 мкМ для ацикловира; <41,7 мкМ для
пенцикловира, и <195,8 мкМ для фоскарнета [42]. Кроме того,
2 изолята, выделенные от ВИЧ-инфицированных пациентов после
26 и 30 недель супрессивной терапии валацикловиром (1000 мг
1 раз в день) сохранили нормальную чувствительность к
исследуемым противовирусным препаратам. Все 11 изолятов,
полученных от 8 ВИЧ-инфицированных пациентов, принимавших
эпизодическую терапию ацикловиром или валацикловиром, также
имели «бурную» реакцию на ацикловир, пенцикловир и
фоскарнет. Однако количество изолятов было слишком
небольшим, чтобы установить статистически достоверную
частоту развития резистентности к антивирусным препаратам
после приема валацикловира. Тем не менее, отсутствие
признаков резистентности к ацикловиру позволяет
предположить, что штаммы ВПГ у пациентов с нормальным
иммунитетом и больных с иммунодефицитом высоко чувствительны
к острому (эпизодическому) лечению валацикловиром и
сохраняют чувствительность при хронической супрессивной
терапии.
Заключение
Результаты большого числа проведенных крупных
клинических исследований дают уверенность в безопасности
длительной супрессивной терапии валацикловиром в дозах до
1000 мг в день с целью профилактики рецидивов генитальной
герпесвирусной инфекции у пациентов с нормальным иммунитетом
и ВИЧ-инфицированных больных. В рандомизированных
исследованиях установлено, что профили безопасности
валацикловира, ацикловира и плацебо практически не
различаются. Ацикловир показал свою безопасность при
длительном применении в различных группах пациентов. При
этом увеличение содержания ацикловира в организме за счет
применения валацикловира с более высокой биодоступностью,
по-видимому, не оказывает влияния на безопасность его
использования при заболеваниях, вызванных ВПГ.
Продолжается наблюдение за резистентностью к ВПГ
при участии Группы Специалистов по Резистентности
Герпесвирусов [34, 43]. К настоящему времени резистентность
к ацикловиру у пациентов с нормальным иммунитетом
встречается крайне редко (<0,5%). Нечасто она встречается и
у больных с иммунодефицитом (около 5%). Эффективность и
безопасность ацикловира сохраняется даже при длительном
применении ацикловира и валацикловира как в качестве
супрессивной терапии заболеваний, вызванных ВПГ, так и для
эпизодического лечения.
Выражение благодарности
Мы выражаем благодарность Международной Группе
Исследователей по Изучению Валацикловира при Герпесвирусных
Инфекциях за проведение клинических исследований. Мы
благодарим А.Т. Гибб за статистический анализ и Г.Б. Миллер
и Дж.Д. Чалэй за анализ и интерпретацию данных по
безопасности длительного применения валацикловира.
Таблица 1. Встречаемость наиболее частых нежелательных
явлений (%) у пациентов, получавших длительную супрессивную
терапию ацпкиловиром
³10
лет [1,2].
|
Годы |
Терапия (n) |
Тошнота |
Диарея |
Головная боль |
Сыпь |
Астения |
Головокружение |
Боли в животе |
Вагинит |
|
1 |
П
(586) |
4,8 |
2,4 |
1,9 |
1,7 |
1,2 |
1,2 |
0,9 |
1,1 |
|
|
Э
(589) |
2,4 |
2,7 |
2,2 |
1,5 |
1,2 |
1,2 |
1,7 |
0 |
|
2 |
П
(698) |
0,7 |
0,1 |
1,9 |
1,1 |
0,2 |
1,1 |
1,1 |
0,3 |
|
|
Э
(85) |
1,1 |
1,1 |
2,4 |
0 |
0 |
2,4 |
0 |
2,3 |
|
5 |
П
(430) |
0,2 |
0,2 |
1,2 |
0 |
0,2 |
0 |
0,2 |
1,7 |
|
9 |
П
(152) |
0 |
0,7 |
1,3 |
0 |
0 |
0 |
0,7 |
0 |
Примечания: Э – эпизодическое лечение (+ супрессивная
терапия плацебо в течение года 1); С – супрессивная терапия
Таблица 2. Основные показатели, отражающие содержание
ацикловира в плазме крови, после приема внутрь ацикловира и
валацикловира
|
|
Валацикловир |
|
Схема приема |
Сmax
(мкМ) |
Дневная
AUC
(мкМ/ч) |
|
Ацикловир 400 мг 2 раза в день |
2,6 [18], 2,9 [16] |
33,4 [16], 37,3 [18] |
|
Валацикловир 250 мг 2 раза в день |
6,9 [16] |
54,5 [16] |
|
Валацикловир 500 мг 1 раз в день |
10,9 [16] |
45,5 [16] |
|
Валацикловир 500 мг 2 раза в день |
9,5 [18], 12,3 [15] |
99,5 [15], 108,8 [18] |
|
Валацикловир 1000 мг 1 раз в день |
17,2 [18], 22,6 [16] |
79,8 [16], 104,3 [18] |
AUC
– площадь под кривой концентрации
Таблица 3. Основные исследования эффективности супрессивной
терапии валацикловиром у пациентов с рецидивирующими
заболеваниями, вызванными вирусом простого герпеса
|
№
исследования, источник литературы |
Группа исследования |
Число включенных пациентов |
Число пациентов, принимавших валацикловир |
Общая дневная доза валацикловира, мг |
Препарат сравнения (общая дневная доза) |
Продолжительность исследования |
|
1
[17] |
Иммунокомпетентные |
382 |
288 |
500 |
Плацебо |
16
недельа |
|
2
[16] |
Иммунокомпетентные |
1479 |
269 |
250 |
Ацикловир (800 мг) |
1
год |
|
|
|
|
540 |
500 |
Плацебо |
|
|
|
|
|
269 |
1000 |
|
|
|
3
[20] |
Иммунокомпетентные |
127 |
127 |
500 |
- |
1
год |
|
4
[18] |
ВИЧ-инфицированные |
1062 |
713 |
1000 |
Ацикловир (800 мг) |
1год |
|
Всего |
|
3050 |
2206 |
|
|
|
ВИЧ –
вирус иммунодефицита человека
а313
пациентов продолжили принимать валацикловир (открытая фаза
исследования) до достижения 1-годичного курса лечения
Таблица 4. Наиболее частые нежелательные явления, отмеченные
при приеме валацикловира (250-1000 мг в день) и ацикловира
(800 мг в день) в течение различного времени (до 1 года). В
таблице представлены все нежелательные явления (в
процентах), независимо от наличия связи с исследуемым
препаратом. Кроме того, в скобках представлен процент
явлений, связанных с приемом исследуемого препарата.
|
|
Группа исследования, источник литературы (№
исследования) |
|
|
Иммунокомпетентные пациенты [16,17,20] (1-3) |
ВИЧ-инфицированные [18] (4) |
|
|
Валацикловир |
Ацикловир |
Плацебо |
Валацикловир |
Ацикловир |
|
Явление |
(n=1493) |
(n=267) |
(n=228) |
(n=713) |
(n=349) |
|
Головная боль |
32
(12) |
37
(12) |
25
(3) |
18
(5) |
17
(7) |
|
Ринит |
20
(<1) |
25
(<1) |
15
(0) |
12
(<1) |
12
(0) |
|
Инфекционные заболевания |
15
(2) |
21
(0) |
11
(0) |
18
(0) |
13
(1) |
|
Тошнота |
10
(6) |
12
(6) |
8
(7) |
12
(6) |
14
(5) |
|
Фарингит |
9
(1) |
11
(0) |
10
(<1) |
11
(0) |
13
(0) |
|
Диарея |
8
(3) |
12
(5) |
10
(4) |
20
(5) |
19
(4) |
|
Боль в животе |
8
(3) |
7
(3) |
4
(3) |
11
(3) |
7
(2) |
|
Сыпь |
6
(1) |
6
(1) |
7
(1) |
15
(1) |
14
(2) |
|
Депрессия |
4
(1) |
4
(1) |
3
(1) |
10
(1) |
11
(0) |
|
Лихорадка |
2
(<1) |
<1
(0) |
1
(0) |
10
(0) |
11
(<1) |
|
Всего |
82
(32) |
85
(31) |
67
(24) |
77
(28) |
77
(25) |
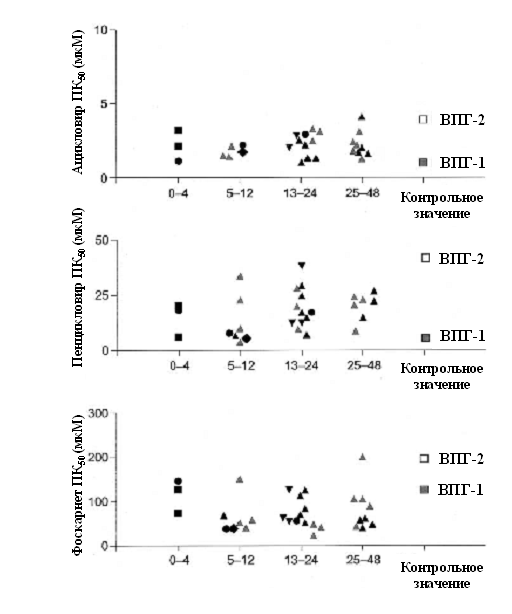
Рисунок 1.
Чувствительность изолятов вируса простого герпеса (ВПГ) к
ацикловиру, выделенных от пациентов с нормальным
иммунитетом, получающих валацикловир (250 мг 1 раз в день
[черные треугольники], 250 мг 2 раза в день [черные ромбы],
500 мг 1 раз в день [черные треугольники вершиной книзу] или
1000 мг 1 раз в день [черные квадраты], ацикловир (400 мг 2
раза в день [черные круги] или плацебо [серые треугольники]
в качестве подавляющей терапии генитального герпеса
продолжительностью до 1 года [41].
Эффективность и долгосрочная
безопасность валацикловира в лечении заболеваний, вызванных
вирусом простого герпеса. Обобщенный 20-летний опыт
применения ацикловира.
Стивен К. Тайринг1, Дэвид Бэйкер2 и Уэнди Сноуден3
Stephen K. Tyring1, David Baker2, и Wendy Snowden3
1. Университет Техаса,
Медицинский факультет, Гальвестон;
2.
Государственный Университет
Нью-Йорка,
3.
Отдел Исследований и
Развития GlaxoSmithKline, Стивенэйдж, Великобритания
1. University of Texas
Medical Branch, Galveston;
2.
State University of New
York at Stony Brook;
3.
GlaxoSmithKline Research
and Development, Stevenage, United Kingdom
СПИСОК ЛИТЕРАТУРЫ:
1.
Mertz
GJ,
Eron
L,
Kaufman
R,
et
al.
Prolonged continuous versus intermittent oral acyclovir
treatment in normal adults with frequently recurring genital
herpes simplex virus infection. Am J Med 1988; 85:14–9.
2. Baker DA,
Safrin S, Deeter RG, Walker A, Barton G, and the Aciclovir
Study Group. Nine-year effectiveness of continuous
suppressive therapy with aciclovir in patients with
recurrent genital herpes [abstract P220]. In: Program and
abstracts of the Congress of the European Academy of
Dermatology and Venereology (Brussels). J Eur Acad Dermatol
Venereol 1995; 5(Suppl 1):S169.
3. Amir J,
Harel L, Smetana Z, Varsano I. Treatment of herpes simplex
gingivostomatitis with aciclovir in children—a randomised
double blind placebo controlled study. BMJ 1997; 314:1800–3.
4. Sullender
WM, Arvin AM, Piaz PS, et al. Pharmacokinetics of acyclovir
in infants and children. Antimicrob Agents Chemother 1987;
31:1722–6.
5. Dunkle LM,
Arvin AM, Whitley RJ, et al. A controlled trial of acyclovir
for chickenpox in normal children. N Engl J Med 1991;
325:1539–44.
6. Kimberlin
D, Powell D, Gruber W, et al. Administration of oral
acyclovir suppressive therapy after neonatal herpes simplex
virus disease limited to the skin, eyes and mouth: results
of a phase I/II trial. Pediatr Infect Dis J 1996; 15:247–54.
7.
Reiff-Eldridge R, Heffner CR, Ephross SA, et al. Monitoring
pregnancy outcomes after prenatal drug exposure through
prospective pregnancy registries: a pharmaceutical company
commitment. Am J Obstet Gynecol 2000; 182:159–63.
8. Scott LL,
Sanchez PJ, Jackson GL, Zeray F, Wendel GD. Acyclovir
suppression
to prevent
cesarean delivery after first-episode genital herpes. Obstet
Gynecol 1996; 87:69–73.
9.
Stray-Pedersen B. Acyclovir in late pregnancy to prevent
neonatal herpes simplex. Lancet 1990; 336:756.
10.
Brocklehurst P, Kinghorn G, Carney O, et al. A randomised
placebo controlled trial of suppressive acyclovir in late
pregnancy in women with recurrent genital herpes infection.
Br J Obstet Gynaecol 1998; 105:275–80.
11. Leen CLS,
Mandal BK, Ellis ME, Brettle RP. Acyclovir and pregnancy.
BMJ
1987;
294:308.
12. Boyd K,
Walker E. Use of acyclovir to treat chickenpox in pregnancy.
BMJ 1988; 296:393–4.
13. De
Miranda P, Blum MR. Pharmacokinetics of acyclovir after
intravenous and oral administration. J Antimicrob Chemother
1983; 12(Suppl B): 29–37.
14. Weller S,
Blum R, Doucette M, et al. Pharmacokinetics of the acyclovir
prodrug
valaciclovir
after escalating single- and multiple-dose administration to
normal volunteers. Clin Pharmacol Ther 1993; 54:595–605.
15. Bodsworth
NJ, Crooks RJ, Borelli S, et al. Valaciclovir versus
aciclovir in patient initiated treatment of recurrent
genital herpes: a randomised, double blind clinical trial.
Genitourin Med 1997; 73:110–6.
16. Reitano
M, Tyring S, Lang W, et al. Valaciclovir for the suppression
of recurrent genital herpes simplex virus infection: a
large-scale dose range-finding study. J Infect Dis 1998;
178:603–10.
17. Patel R,
Bodsworth N, Woolley P, et al. Valaciclovir for the
suppression of recurrent genital HSV infection: a placebo
controlled study of once-daily therapy. Genitourin Med 1997;
73:105–9.
18. Conant
MA, Schacker T, Murphy RL, et al. Valaciclovir versus
aciclovir for herpes simplex virus infection in HIV-infected
individuals—two randomised trials. Int J STD AIDS 2002;
13:12–21.
19. Szczech
GM. Preclinical development of antiviral drugs. Clin Infect
Dis 1996; 22:355–60.
20. Baker DA,
Blythe JG, Miller JM. Once-daily valacyclovir hydrochloride
for suppression of recurrent genital herpes. Obstet Gynecol
1999; 94:103–6.
21. Bell WR,
Chulay JD, Feinberg JE. Manifestations resembling thrombotic
microangiopathy in patients with advanced human
immunodeficiency virus (HIV) disease in a cytomegalovirus
prophylaxis trial (ACTG 204). Medicine 1997; 76:369–80.
22. Ljungman
P, de la Camara R, Milpied N, et al. Randomized study of
valacyclovir
as
prophylaxis against cytomegalovirus reactivation in
recipients of allogeneic bone marrow transplants. Blood
2002; 99:3050–6.
23. Feinberg
JE, Hurwitz S, Cooper D, et al. A randomized, double-blind
trial of valaciclovir prophylaxis for cytomegalovirus
disease in patients with advanced human immunodeficiency
virus infection. J Infect Dis 1998; 177: 48–56.
24. Leaf AN,
Laubenstein LJ, Raphael B, Hochster H, Baez L, Karpaktin S.
Thrombotic thrombocytopenic purpura associated with human
immunodeficiency virus type 1 (HIV-1) infection. Ann Intern
Med 1988; 109: 194–7.
25. Fish DN,
Vidaurri VA, Deeter RG. Stability of valacyclovir
hydrochloride in extemporaneously prepared oral liquids. Am
J Health Syst Pharm 1999; 56:1957–60.
26. Eksborg
S, Pal N, Kalin M, Palm C, Soderhall S. Pharmacokinetics of
acyclovir
in
immunocompromised children with leukopenia and mucositis
after chemotherapy: can intravenous acyclovir be substituted
by oral valacyclovir? Med Pediatr Oncol 2002; 38:240–6.
27. Simon MW,
Fish D, Deeter RG. Pharmacokinetics and safety of
valacyclovir in children with EBV illness [abstract 48.006].
Presented at the 8th International Congress on Infectious
Diseases, Boston, 1998.
28. Nadal D,
Leverger G, Sokal EM, et al. An investigation of the
steady-state pharmacokinetics of oral valacyclovir in
immunocompromised children. J Infect Dis 2002; 186(Suppl
1):S123–30 (in this issue).
29. Lowance
D, Neumayer HH, Legendre CM, et al. Valacyclovir for the
prevention of cytomegalovirus disease after renal
transplantation. N Engl J Med 1999; 340:1462–70.
30. Kimberlin
DF, Weller S, Whitley R, et al. Pharmacokinetics of oral
valacyclovir and acyclovir in late pregnancy. Am J Obstet
Gynecol 1998; 179: 846–51.
31. Hill EL,
Hunter GA, Ellis MN. In vitro and in vivo characterization
of herpes simplex virus clinical isolates recovered from
patients infected with human immunodeficiency virus.
Antimicrob Agents Chemother 1991; 35: 2322–8.
32. Sacks SL,
Wanklin RJ, Reece DE, et al. Progressive esophagitis from
acyclovir-resistant herpes simplex. Clinical roles for DNA
polymerase mutants and viral heterogeneity? Ann Intern Med
1989; 111:893–9.
33. Safrin S,
Kemmer S, Plotkin B, et al. Foscarnet-resistant herpes
simplex virus infection in patients with AIDS. J Infect Dis
1994; 169:193–6.
34. Reyes M,
Graber JM, Weatherall N, Hodges-Savola C, Reeves WC.
Acyclovir-resistant
herpes simplex virus: preliminary results from a national
surveillance system. Antiviral Res 1998; 37:A44.
35.
Christophers J, Clayton J, Craske J, et al. Survey of
resistance of herpes simplex virus to acyclovir in northwest
England. Antimicrob Agents Chemother 1998; 42:868–72.
36. Fife KH,
Crumpacker CS, Mertz GJ, Hill EL, Boone GS, Acyclovir Study
Group. Recurrence and resistance patterns of herpes simplex
virus following cessation of
³6
years of chronic suppression with acyclovir. J Infect Dis
1994; 169:1338–41.
37. Kost RG,
Hill EL, Tigges M, Straus SE. Brief report: recurrent
acyclovir-resistant
genital
herpes in an immunocompetent patient. N Engl J Med 1993;
329:1777–82.
38. Englund
JA, Zimmerman ME, Swierkosz EM, et al. Herpes simplex virus
resistant to acyclovir. A study in a tertiary care center.
Ann Intern Med 1990; 112:416–22.
39. Harden
EA, Rybak RJ, Hartline C, et al. Cross susceptibility
patterns and neuro-virulence of acyclovir-resistant herpes
simplex virus (HSV) isolates collected in a national
surveillance study. Antiviral Res 2000; 46:A78.
40. Boon RJ,
Bacon TH, Robey HL, et al. Antiviral susceptibilities of
herpes simplex virus from immunocompetent subjects with
recurrent herpes labialis: a UK-based survey. J Antimicrob
Chemother 2000; 46:324–5.
41. Snowden
W, Manohitharajah V, Crooks J. Antiviral sensitivity of
herpes simplex virus isolates from patients participating in
the valaciclovir genital herpes simplex programme.
Antiinfective Drugs Chemother 1998; 16(Suppl 1):19.
42. Collins
P, Ellis MN. Sensitivity monitoring of clinical isolates of
herpes simplex virus to acyclovir. J Med Virol 1993; (Suppl
1):58–66.
43.
Weatherall NT, Hodges-Savola CA, Reyes M, et al.
Acyclovir-resistant herpes
simplex
virus: characterization of virus isolates from a nationwide
surveillance system. Antiviral Res 1998; 37:A44.
ОБСУДИТЕ
СТАТЬЮ В ФОРУМЕ
|
